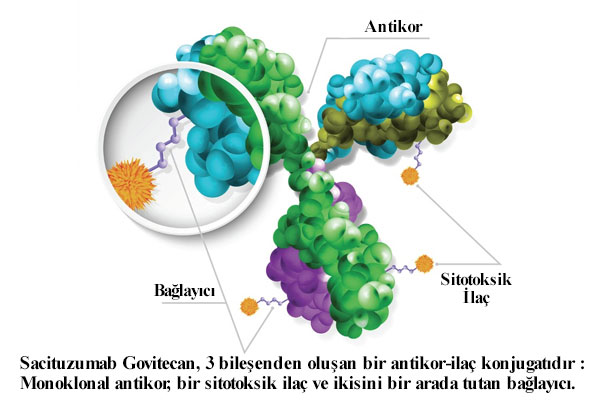
Sacituzumab Govitecan İleri Evre Hormon Pozitif Meme Kanserinde FDA onayı aldı
3 Şubat 2023'te ABD Gıda ve İlaç İdaresi (FDA), ameliyat edilemeyen lokal ileri veya metastatik (4.evre) olup endokrin bazlı tedavi ve en az iki basamak sistemik tedavi almış hormon reseptörü (HR)-pozitif, insan epidermal büyüme faktörü reseptörü 2 (HER2) negatif olan hastalar için sacituzumab govitecan-hziy'i (Trodelvy, Gilead Sciences, Inc.) onayladı
Etkinlik, çok merkezli, açık etiketli, randomize bir çalışma olan TROPiCS-02'de (NCT03901339) değerlendirildi. Çalışmaya opere edilemeyen lokal olarak ilerlemiş veya metastatik HR-pozitif, HER2-negatif meme kanserli 543 hasta alındı. Hastalar önceden bir basamak kemoterapi ve CDK 4/6 inhibitörü ve endokrin tedavi almış ve hastalığı yine de ilerlemiş hastalardı. ve hastalığı herhangi bir ortamda aşağıdakilerden sonra ilerledi: a CDK 4 /6 inhibitörü, endokrin
Hastalar, 21 günlük bir döngünün 1. ve 8. günlerinde (n=272) intravenöz infüzyon olarak 10 mg/kg sacituzumab govitecan-hziy veya tek ajan kemoterapi (n=271) kollarına randomize edildi (1:1). Tek ajanlı kemoterapi, araştırmacı tarafından randomizasyon öncesi aşağıdaki seçeneklerden biriolacak şekilde belirlendi: eribulin (n=130), vinorelbin (n=63), gemsitabin (n=56) veya kapesitabin (n=22). Randomizasyon aşağıdaki faktörlere göre sınıflandırıldı: metastatik hastalık için önceki kemoterapi rejimleri (2'ye karşı 3-4), visseral metastaz (evet veya hayır) ve metastatik ortamda en az 6 ay boyunca endokrin tedavisi (evet veya hayır). Hastalar, hastalık progresyonuna veya kabul edilemez toksisiteye kadar tedavi edildi.
Birincil etkililik sonuç ölçüsü, RECIST v1.1'e göre körlenmiş bağımsız merkezi inceleme tarafından belirlenen progresyonsuz sağkalım (PFS) idi. Önemli bir ikincil etkililik sonuç ölçüsü, genel sağkalımdı (OS). Medyan PFS sacituzumab govitecan-hziy kolunda 5,5 ay (%95 güven aralığı [GA] 4,2, 7,0) ve tek ajan kemoterapi kolunda 4 ay (%95 GA 3,1, 4,4) olmuştur (tehlike oranı [HR] 0,661, %95 GA 0,529, 0,826; p-değeri = 0,0003). Medyan OS sacituzumab govitecan-hziy (%95 GA 13.0, 15.7) alanlarda 14.4 ay ve tek ajan kemoterapisi alanlarda 11.2 ay (%95 GA 10.1, 12.7) idi (HR 0.789, %95 GA 0.646, 0.964; p -değer = 0,0200).
TROPiCS-02'de sacituzumab govitecan-hziy ile tedavi edilen hastalarda laboratuvar anormallikleri dahil en yaygın advers olaylar (≥%25), lökosit sayısında azalma (%88), nötrofil sayısında azalma (%83), azalmış hemoglobin (%73), azalmış lenfosit sayısı (%65), ishal (%62), yorgunluk (%60), bulantı (%59), alopesi (%48), artmış glukoz (%37), kabızlık (%34) ve azalmış albümin (32) %).
Önerilen sacituzumab govitecan-hziy dozu, hastalıkta kabul edilemez toksisitenin ilerlemesine kadar 21 günlük tedavi döngülerinin 1. ve 8. Günlerinde haftada bir kez intravenöz infüzyon şeklinde uygulanan 10 mg/kg'dır.
Trodelvy bu çalışma ile üçlü negatif hastalarda olduğu gibi hormon reseptörü pozitif ilerlemiş evre meme kanserli hastalarda da önemli bir tedavi seçeneği gibi görünmektedir.