HER 2 POZİTİF MEME KANSERİNDE BAŞARILI AJAN ENHERTU
4 Mayıs 2022'de ABD Gıda ve İlaç Dairesi (FDA), daha önce anti-HER2 bazlı tedavi almış ileri evre HER2 pozitif meme kanseri olan yetişkin hastalar için Enhertu’yu (trastuzumab deruxtecan) onayladı.
Onay DESTINY-Breast03 çalışma sonuçlarına dayanmaktadır. Bu çalışmada HER2 pozitif ileri evre/metastatik meme kanseri olan ve daha önce trastuzumab ve taksan tedavisi almış hastalığı bu tedavi ile ilerlemiş 524 hasta 1:1 oranında Enhertu veya Tradtuzumab emtansin kollarına ayrıldırlar.
Enhertu alan hastalarda objektif yanıt oranı %82,7 iken trastuzumab emtansin kolunda bu oran %36,1 olarak saptanmıştır.
Progresyona kadar geçen süre: tedavinin 1 yılında trastuzuzamb deruxtekan kolunda %75 hastada kanser kontrol altında iken , diğer tedavi kolu olan trastuzumab emtansin kolunda ise %34 hastada kontrol sağlanmıştır.
Enhertu alan hastalarda en yaygın yan etkiler bulantı, yorgunluk, kusma, saç dökülmesi, kabızlık, anemi ve kas-iskelet ağrısıydı.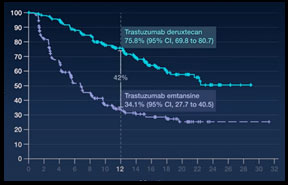
Meme kanseri için önerilen Enhertu dozu, hastalık progresyonuna veya kabul edilemez toksisiteye kadar her 3 haftada bir (21 günlük döngü) intravenöz infüzyon olarak verilen 5,4 mg/kg'dır.
Ülkemizde henüz kullanım onayı bulunmayan Enhertu tedavisi için detaylı bilgiye onkoloji uzmanlarınızdan ulaşabilirsiniz. Ülkemizde Samsun Medicalpark Hastanesi dahil birkaç merkezde klinik çalışmaları devam etmektedir.

